East Asian Arch Psychiatry 2013;23:109-13
专题文章
不同亚型阿兹海默病患者的血脂、胰岛素代谢和对氧磷酶-2基 因311位点多态性研究
沐楠、徐世超、常青、饶冬萍、陈建平、马崔
沐楠主任医师,中国广州市脑科医院/暨南大学第一临床医学院
徐世超主治医师,中国广州市脑科医院
常青医师,中国广州市脑科医院
饶冬萍主治医师,中国广州市脑科医院
陈建平副主任医师,中国广州市脑科医院
马崔主任医师,中国广州市脑科医院
通讯作者:沐楠医师,中国广州市荔湾区明心路36号邮编:510370
电话:(86-20) 8126 8082;传真:(86-20) 8189 1391;
电邮:gzmunan@hotmail.com
收稿日期:2013年3月19日; 收回日期:2013年6月10日
摘要
目的:探讨根据中国精神障碍分类与诊断标准第3版(CCMD-3)诊断的老年型、老年前期型和混合型阿兹海默病(AD)患者间血脂、胰岛素代谢、对氧磷酶-2(PON2)基因311位点多态性的差异和特点。
方法:研究对象包括84例AD患者,符合美国国立神经病学、语言障碍和卒中研究所——阿兹海默病和相关疾病协会(NINCDS-ADRDA)「可能AD」的诊断标准且无痴呆家族史。根据CCMD-3分为老年型、老年前期型和混合型叁组,用聚合酶链反应-限制性片段长度多态性分析法检测患者PON2基因311位点多态性,检测血清胆固醇、甘油叁脂、高密度脂蛋白、低密度脂蛋白和空腹血糖。利用化学发光法测空腹血清胰岛素。利用基础状态法评定胰岛素抵抗 性,临床上可使用胰岛素敏感指数表达。应用简明智能评定量表(MMSE)、日常生活能力量表(ADL)和Hachinski缺血量表等评定叁组患者的认知等临床特征,并分析叁组间PON2基因311C/S位点多态性、血清胰岛素、血糖、血脂和神经心理学量表得分的差异。
结果:老年前期型组的血清甘油叁脂和胆固醇均高于老年型和混合型组,差异有统计学意义(p值< 0.01) 。老年型组的高密度脂蛋白水平高于混合型组(p值 < 0.05)。老年前期型组的
血清胰岛素水平高于老年型(p值 < 0.05)和混合型组(p值 < 0.01)。老年型和混合型组之间PON2基因311C/C、C/S和S/S位点分布无显着差异,两组间C和S位点基因频率也无统计学差异。
结论:老年型、老年前期型和混合型叁组AD患者的血清甘油叁脂、胆固醇、高密度脂蛋白和胰岛素水平有差异,提示对老年前期型AD患者应加强血脂和胰岛素代谢的重视和干预。混合型和老年型组其PON2基因311位点及等位基因频率未发现显着差异。
关键词:阿兹海默病、芳香二烷基磷酸酯酶、胰岛素、血脂、基因多态性
前言
阿兹海默病(Alzheimer's disease, AD)是中枢神经系 统原发性退行性变性疾病,是老年期痴呆最常见的一 种。该病已成为许多发达国家和发展中国家主要保健 和社会问题。按照目前我国精神科医师常用的中国精神障碍分类与诊断标准第3版(CCMD-3)[1],AD主要分为老年型、老年前期型和混合型三种亚型。 AD发病是遗传易感性与环境因素共同作用的结果,对于散发性AD目前公认的遗传易感基因仅有载脂蛋白APOE ε4等位基因[2],但是APOE ε4只能解释不到50%的AD遗传变异,这就提示还有其他遗传因素参与AD发病。对氧磷酶(paraoxonase,PON)是一类钙离子依赖性高密度脂蛋白相关脂酶,PON基因家族主要包括三个成员:PON1、PON2和PON3,位于人类7号染色体长臂[3 ]。施氏等[4]对中国人群的研究发现,汉族AD 患者中PON2基因311C位点基因频率明显增加,通过与APOE ε4相关性研究显示,311C是独立于APOE ε4 的危险因子。另外国内外不少研究也认为血脂、 胰岛素与AD的发病有关,但和PON2基因311位点多 态性一样都有不一致的研究结论[3-8]。本文以散发性AD 患者为研究对象,探讨CCMD-3不同亚型的AD患者之间PON2基因311位点多态性、血脂、血糖、血清胰岛素水平,以及胰岛素敏感性的差异特点。
对象和方法
研究对象
来自2008年3月至2010年12月期间在广州市脑科医院老年精神科住院以及门诊确诊的84例AD患者。所有患者均符合美国国立神经病学、语言障碍和卒中研究所—— 阿兹海默病和相关疾病协会( NINCDS - ADRDA)「可能AD」的诊断标准且无痴呆家族史, 经头颅CT或MRI检查,血液生化、梅毒血清学及血液甲状腺功能等检查排除其他系统性疾病和其他器质性脑病所致的记忆障碍,再按照目前我国精神科医师常用的CCMD-3,把这些AD患者分为老年型、老年前期型和混合型三组,入组患者分别为49人,7人和28人。由2名精神科医师共同诊断,其中一位副高以上职称的医师负责诊断覆核。所有入组患者和其家属均对本研究知情同意。
血液生化指标检测
抽取空腹静脉血5 mL血液标本。采用雅培c8000全自动生化分析仪检测血清胆固醇、甘油三酯、高密度脂蛋白、低密度脂蛋白和空腹血糖(FBS)。在拜尔Centaur免疫发光仪上,利用化学发光法测空腹血清胰岛素(FINS)。
胰岛素抵抗性
采用李氏等[9]提出的基础状态法评定胰岛素抵抗性,使用胰岛素敏感指数(ISI)表达。 ISI等于血清胰岛素与空腹血糖乘积倒数的自然对数(ISI = In [1/FBS × FINS])。
对氧磷酶-2基因311位点多态性检测
采用PCR-RFLP方法测定。引物分别为5-GTG ACA TGC ATG TAC GGT GGT CT-3和5-ACA AGG CTC TGT GGT ATA AAG TGC C-3,PCR反应体积为25 μL,其中Taq DNA聚合酶0.2 μL(5 U/μL), 10x PCR buffer(含Mg2+缓冲液)2.5 μL;dNTP 混合物2 μ L ( 各为2 . 5 mmol / L ) ; DNA 模板2 μ L(≤ 2.5 ng);引物各0.5 μL(10 pmol/μL);加双蒸水至25 μL。 PCR反应条件为94℃,5分钟;继而 94℃,30秒;57℃,45秒和72℃,60秒(共38个循环)。之后为72℃,7分钟;4℃低温保存。 PCR产物的片断大小为197 bp,将PCR产物中加入5 U限制性内切酶DdeI,建立酶切反应体系,置37℃恒温水浴箱内消化4至16小时。消化完成后于每一个标本内加入5 μL的6x loading buffer,于8%聚丙烯酰胺凝胶电泳分离,电压为180 V,电泳3小时后进行硝酸银染色和分型。 S/S纯合子为78 bp、70 bp,C/C纯合子为 148 bp,C/S杂合子为148 bp、78 bp和70 bp[10]。
临床神经心理学量表评估
包括简易智能评定量表(MMSE)评估认知功能、日常生活能力量表( ADL ) 评估日常生活功能损害程度、Hachinski缺血量表鉴别血管性痴呆和老年性痴呆、 Hamilton抑郁量表(HAMD)评估抑郁症状。量表 评定者为2名精神科住院医师,研究前经过培训并进行 一致性检验,一致性高于95%。
统计学分析
应用SPSS 16.0软件进行统计处理。各种计量资料测定结果以均数 ± 标准差表示,计量资料两组以上比较采用方差分析。计数资料、等级资料间比较采用卡方检验,组间等位基因和基因型频率比较采用卡方检验。 p值 < 0.05为差异具有统计学意义。
结果
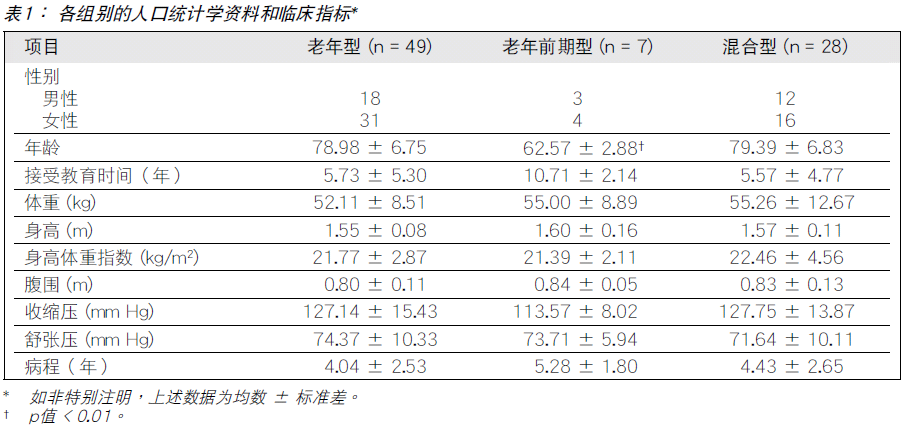
人口统计学资料和临床指标
三组患者一般人口统计学资料和临床指标详见于表1。年龄方面,老年前期型组低于其他两组,差异有统计 学意义(p值 < 0.01)。三组间在余项的差异并无统计 学意义(p值 > 0.05)。
由于老年前期型入组仅7人,分析意义不大,因此部份项目仅比较老年型和混合型AD两组数据。
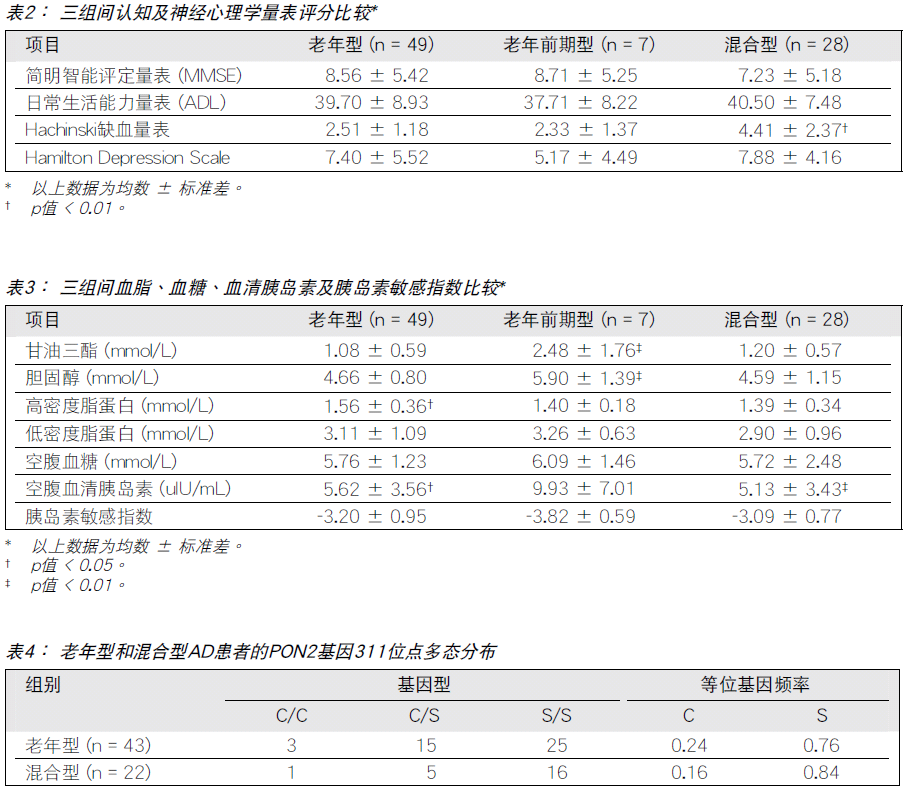
神经心理学量表评分
混合型组的Hachinski缺血量表评分高于老年前 期 型 组和老年型组,差异有统计学意义(p值 < 0.01), 见表2。
血生化指标和胰岛素敏感指数
老年前期型组的甘油三脂和胆固醇水平高于老年型组 和混合型组,差异有统计学意义(p值 < 0.01)。高 密度脂蛋白水平方面,老年型组高于混合型组,差异 有统计学意义(p值 < 0.05)。血清胰岛素水平方面,老年前期型组高于老年型组(p值 < 0.05)和混 合型组(p值 < 0.01),差异有统计学意义。余项差异并无统计学意义,见表3。
对氧磷酶-2基因311位点基因型和等位基因频率
老年型、混合型AD两组间PON2基因311位点基因型和等位基因频率经卡方检验, 差异并无统计学意义(p值> 0.05),见表4 。
讨论
AD 常用的诊断标准有ICD-10、DSM-Ⅳ、NINCDS- ADRDA和CCMD-3,其中CCMD-3是中国精神科临床常用的诊断标准,它根据起病年龄、临床特点,以及是否同时符合血管性痴呆的诊断标准将AD主要划分为老年前期型、老年型和混合型。前两型以起病年龄在65岁来划分,混合型是指符合AD的诊断标准,但临床表现不典型,如65岁以后起病却具有老年前期型临床特征或同时符合脑血管病所致痴呆的诊断标准, 但又难以做出并列诊断者。本项目中三组患者病程时间差异无统计学意义,但年龄方面,老年前期型组为62.57 ± 2.88岁,明显低于其他两组,与诊断标准相符,提示老年前期型患者起病较早。本研究结果显示 混合型AD的Hachinski缺血量表评分高于老年前期型和 老年型AD,差异有统计学意义(p值 < 0.01)。这也 符合CCMD关于分型的诊断标准。 Hachinski缺血量表是 常用的鉴别血管性痴呆和AD的量表,得分越高,意味 着血管性痴呆的可能性越大。研究结果提示混合型AD 患者兼具AD和血管性痴呆的特点,这些血管性痴呆的特征包括急性起病、阶梯样病程、卒中发作史、动脉硬化病史、局灶性神经系统定位体征、夜间意识模糊、人格完整性和情感脆弱等。
心血管危险因子与AD密切相关[11],流行病学资料显示高脂血症可较AD早发10至15年[12 ],目前认为它是引发AD的独立风险因素。系统综述和荟萃分析提示,总胆固醇与老年痴呆的关系依赖于年龄,即中年总胆固醇水平高与晚年发生老年痴呆的风险增加有关,而晚年总胆固醇水平和老年痴呆之间没有关系或呈负相关[13,14]。我们前期的研究也支持这个观点[15,16]。细胞内胆固醇水平的高低与Aβ前体蛋白(APP)代谢有关。正常情况下,APP在体内的分解主要由α-分泌酶和γ-分泌酶进行,产生可溶性的APPα,但在AD患者中,APP的分解主要由β-分泌酶和γ-分泌酶进行,产生过多的Aβ,最终形成神经炎性斑块。当胆固醇水平升高时,α-分泌酶活性受到抑制,从而促进APP通过β-分泌酶途径进行分解。本研究结果显示老年前期型组的甘油三脂和胆固醇水平高于老年型组和混合型组,差异有统计学意义(p值<0.01),而老年型组的高密度脂蛋白水平高于混合型组,差异有统计学意义(p值<0.05)。不过,目前关于AD患者血液胆固醇水平的研究结果尚不一致[17,18],原因可能在于各个研究选取的AD患者类型有所差异,这提示在进行AD研究时,选择样本尽可能纯化相同诊断亚型。一般认为高密度脂蛋白对心脑血管疾病具有保护性作用,本研究结果提示老年型组血脂保护性成分高密度脂蛋白高于混合型组。
胰岛素抵抗是指胰岛素介导的降血糖能力降低,机体为保护内环境稳定和血糖正常,代偿性胰岛素分泌增加引致高胰岛素血症。研究表明胰岛素抵抗导致的高血糖和高胰岛素血症可能通过加速神经元纤维缠结的形成,影响Aβ聚集、Tau蛋白的异常磷酸化和诱发炎症等机制促进AD的发生。胰岛素和胰岛素样生长因子在与学习和记忆密切相关的神经元存活、能量代谢和可塑性过程中发挥重要作用[19-21]。杜氏等[22]采用体外培养的神经细胞和痴呆大鼠模型进行研究,认为Aβ可引起神经元损害和学习记忆功能障碍,其主要机制可能是介导了海马神经元胰岛素信号转导通路功能异常。目前不少研究显示AD可能是一种缺乏周围性胰岛素抵抗,而仅表现为特异性的中枢神经系统胰岛素缺陷或胰岛素抵抗的「3型糖尿病」[23]。本研究显示老年前期型的血清胰岛素水平高于老年型(p值<0.05)和混合型(p值<0.01),差异有统计学意义,但三组间的ISI差异无统计学意义,提示以ISI代表的周围性胰岛素抵抗性三组间无显著差异,不过老年前期型的胰岛素水平升高可能较其他两型更为明显。
施氏等[4]研究165例散发性AD患者与174例正常对照组的PON2基因,推测中国汉族AD患者PON2基因311C位点是独立于APOEε4的危险因子。邬氏与钱氏[24]则未发现PON2基因311C/S位点多态性与AD之间存在明显相关性。张氏等[25]对110例脑梗死患者及100健康对照者的研究则提示,PON2基因311C/S位点多态性的G等位基因可能是中国山西地区汉族人群脑梗死的危险因子。吴氏等[8]对22例AD患者和31例年龄匹配的健康对照者进行研究,认为海南地区PON2基因311C/S位点多态性及血脂血糖指标与AD没有显著相关性。本研究未发现两种AD亚型患者间PON2基因311等位基因频率和基因型分布有统计学差异,提示老年型和混合型AD在该种遗传多态性上无显著差异。脂蛋白代谢的改变以及氧化应激的异常,是神经系统变性疾病AD的重要原因。 PON作为抗氧化酶,可能是通过保护机体对有毒环境暴露而发挥作用[26]。 PON2能够降低细胞内氧化应激水平,阻止细胞介导的低密度脂蛋白氧化作用,还可能参与PON1和PON3的减少血管氧自由基的作用,从而对细胞的凋亡及动脉硬化过程产生影响,而氧化应激也是AD这种复杂疾病病因的重要假说[27]。 Bourquard氏等[28]的动物研究表明PON2在肝脏胰岛素信号通路中起重要作用,通过巨噬细胞介导的炎性反应对肝脏胰岛素敏感性产生影响。不过,PON2对大脑的胰岛素信号系统的作用尚不清楚。本研究的局限性在于AD是一种复杂性疾病,影响发病因素很多,包括饮食、身体锻炼和共存疾病等。这些混杂因素都可能影响血脂和胰岛素代谢。而且CCMD-3的AD诊断标准有其局限性,即其中可能包含相当比例的非AD痴呆,如额颞叶变性导致的原发性进行性失语症和非Aβ病理性的动脉病变导致的血管性脑损伤等。 2011年美国国立老化研究所和AD协会推荐了新的AD诊断标准[29],侧重于强调生物标志物对于AD早期诊断的重要价值,明确提出AD是一个连续的病理生理过程,包括轻度认知障碍前期、轻度认知障碍期和痴呆期。两项标准的结合使用有助加深对这种疾病的认识和增加诊断的精确性。
综上所述,本研究表明采用CCMD-3进行分组的老年型和混合型AD患者在PON2基因311C/S位点多态性上无显著差异,三种亚型AD患者的血脂成份和胰岛素代谢有一定差异。结果提示要特别重视老年前期型AD 患者的血脂和胰岛素代谢的监测和干预,可能对该病 的临床防治有意义。
声明
本文献为广东省自然科学基金资助项目(编号:8151037001000006)和广州市医药卫生科技项目(2007-YB-104)。
参考文献
- 中华医学会:《中国精神障碍分类与诊断标准第三版》,济南: 山东科学技术出版社,2001,页32-4。
- Farrer LA, Cupples LA, Haines JL, Hyman B, Kukull WA, Mayeux R, et al. Effects of age, sex, and ethnicity on the association between apolipoprotein E genotype and Alzheimer disease. A meta-analysis. APOE and Alzheimer Disease Meta Analysis Consortium. JAMA 1997;278:1349-56.
- Pasdar A, Ross-Adams H, Cumming A, Cheung J, Whalley L, St Clair D, et al. Paraoxonase gene polymorphism and haplotype analysis in a stroke population. BMC Med Genet 2006;7:28.
- Shi J, Zhang S, Tang M, Liu X, Li T, Han H, et al. Possible association between Cys311Ser polymorphism of paraoxonase 2 gene and late- onset Alzheimer’s disease in Chinese. Brain Res Mol Brain Res 2004;120:201-4.
- Klimkowicz-Mrowiec A, Marona M, Wolkow P, Witkowski A, Maruszak A, Styczynska M, et al. Paraoxonase gene polymorphism and the risk for Alzheimer’s disease in the polish population. Dement Geriatr Cogn Disord 2011;31:417-23.
- Janka Z, Juhász A, Rimanóczy AA, Boda K, Márki-Zay J, Kálmán J. Codon 311 (Cys->Ser) polymorphism of paraoxonase-2 gene is associated with apolipoprotein E4 allele in both Alzheimer’s and vascular dementias. Mol Psychiatry 2002;7:110-2.
- 许宏伟、赵真、袁宁、肖波、杨晓苏、唐北沙:〈PON2基因C311S、G148A多态性与脑卒中关系的研究〉,《中华医学遗传学杂志》,2007,第24卷,页328-30。
- 吴利、黎元莉、邬强、陈少金、麦珍:〈对氧磷酶2基因311Cys/Ser多态性及血脂血糖指标与海南地区阿尔茨海默病的相关性研究〉,《分子诊断与治疗杂志》,2012,第4卷,页253-6。
- 李光伟、潘孝仁、LilliojaS、BennettPH:〈检测人群胰岛素敏感性的一项新指数〉,《中华内科杂志》,1993,第32卷,页656-60。
- 梁红业、吴白燕、陈大方、杨帆、胡海燕、陈栎等:〈新生儿基因CYP2E15'端RsaI和PON2311位点多态性与早产的关系〉,《遗传学报》,2002,第29卷,页847-53。
- 仇成轩:〈老年痴呆的心血管危险因素相关临床发病机理及人群预防〉,《济宁医学院学报》,2012,第35卷,页78-83。
- Kivipelto M, Helkala EL, Laakso MP, Hänninen T, Hallikainen M, Alhainen K, et al. Midlife vascular risk factors and Alzheimer’s disease in late life: longitudinal population based study. BMJ 2001;322:1447- 51.
- Solomon A, Kivipelto M. Cholesterol-modifying strategies for Alzheimer’s disease. Expert Rev Neurother 2009;9:695-709.
- Anstey KJ, Lipnicki DM, Low LF. Cholesterol as a risk factor for dementia and cognitive decline: a systematic review of prospective studies with meta-analysis. Am J Geriatr Psychiatry 2008;16:343-54.
- 饶冬萍、唐牟尼、马崔、郭扬波、韩海英、黄杏梅等:〈阿尔茨海默病、血管性痴呆血脂浓度分析〉,《临床精神医学杂志》, 2008,第18卷,页220- 2。
- 沐楠、徐世超、常青、陈建平、刘学军、马崔:〈散发性阿尔茨海默病患者胰岛素抵抗与血脂皮质醇的临床研究〉,《广州医药》,2010,第41卷,页3-5。
- Solomon A, Kivipelto M, Wolozin B, Zhou J, Whitmer RA. Midlife serum cholesterol and increased risk of Alzheimer’s and vascular dementia three decades later. Dement Geriatr Cogn Disord 2009;28:75- 80.
- Borroni B, Colciaghi F, Lenzi GL, Caimi L, Cattabeni F, Di Luca M, et al. High cholesterol affects platelet APP processing in controls and in AD patients. Neurobiol Aging 2003;24:631-6.
- Matsuzaki T, Sasaki K, Tanizaki Y, Hata J, Fujimi K, Matsui Y, et al. Insulin resistance is associated with the pathology of Alzheimer disease: the Hisayama Study. Neurology 2010;75:764-70.
- Biessels GJ, Staekenborg S, Brunner E, Brayne C, Scheltens P. Risk of dementia in diabetes mellitus: a systematic review. Lancet Neurol 2006;5:64-74.
- Schrijvers EM, Witteman JC, Sijbrands EJ, Hofman A, Koudstaal PJ, Breteler MM. Insulin metabolism and the risk of Alzheimer disease: the Rotterdam Study. Neurology 2010;75:1982-7.
- 杜怡峰、阎鹏、韩晓娟:〈阿尔茨海默病胰岛素信号传导通路的 研究〉,《济宁医学院学报》,2012,第35卷,页84-92。
- de la Monte SM. Insulin resistance and Alzheimer’s disease. BMB Rep 2009;42:475-81.
- 邬强、钱士匀:〈对氧磷酶2基因多态性与阿尔茨海默病的相关 性研究〉,《中国老年学杂志》,2007,第27卷,页1038-41。
- 张慎韬、李东芳、张华屏、裴宇恒、连霞、刘彩玉:〈对氧磷酶2基因多态性与脑梗死的相关性研究〉,《中西医结合心脑血管病杂志》,2012,第10卷,页686-8。
- Erlich PM, Lunetta KL, Cupples LA, Huyck M, Green RC, Baldwin CT, et al. Polymorphisms in the PON gene cluster are associated with Alzheimer disease. Hum Mol Genet 2006;15:77-85.
- 盛树力:《老年性痴呆及相关疾病》,北京:科学技术文献出版 社,2006,页556-66。
- Bourquard N, Ng CJ, Reddy ST. Impaired hepatic insulin signalling in PON2-deficient mice: a novel role for the PON2/apoE axis on the macrophage inflammatory response. Biochem J 2011;436:91-100.
- Sperling RA, Aisen PS, Beckett LA, Bennett DA, Craft S, Fagan AM, et al. Toward defining the preclinical stages of Alzheimer’s disease: recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease. Alzheimers Dement 2011;7:280-92.